
提示
蛋白結合的解離常數以及在蛋白檢測和親和分離中的應用
2022-01-18
蛋白與配體能否結合、結合的強弱會直接影響蛋白檢測或純化實驗的成敗。此篇文章由月旭科技首席科學家王國斌博士執筆,對蛋白結合和解離常數進行了較為系統的講述。
蛋白和配體結合的強弱不同,對于蛋白檢測以及親和分離純化實驗有顯著影響。在設計實驗時應考慮這種結合強弱影響,以便采用合适的蛋白或配體濃度(包括更低檢測限濃度),估算結合時間,獲得更佳并且實用的結果。 這對于室溫下易失去活性,或希望盡可能保持更高活性蛋白的純化尤為重要。
常規的蛋白檢測方法,比如ELISA,隻能測定實驗結束時的蛋白結合數值,不能跟蹤整個過程。這不利于獲取結合的動力學數據,阻礙了實驗的優化。自從上個世紀90年代Biacore商品化surface plasmon resonance技術後,目前已有幾種生物傳感器技術,能夠跟蹤蛋白和配基的real-time結合過程,檢測結合的全部過程,給出結合的動力學數據。下圖是我在SRU Biosystems用光學生物傳感測定蛋白A和不同濃度人類IgG随時間變化的結合曲線。IgG濃度在100μg/mL時,結合在2-3分鐘内迅速上升後,緩慢增加。在濃度減小時,結合速度變慢。濃度在6.25μg/mL時,結合在180分鐘内持續穩定地增加。濃度小于1μg/mL時,結合仍然進行,但是十分緩慢。
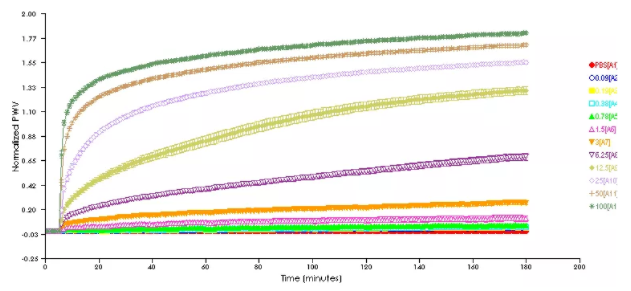
圖1. 10種濃度的人類IgG與光生物傳感器表面
的蛋白A結合的real-time時間曲線。
IgG濃度從100μg/mL,做1:2稀釋,
直到0.09μg/mL(90ng/mL)和0對比。
絕大多數生化實驗室,沒有real-time跟蹤檢測手段,蛋白檢測或者純化過程中,确定蛋白的濃度和結合時間通常根據結合的強弱來确定,而結合強弱是通過解離常數來判斷的。
在化學、生物化學中,解離常數(KD) 是一種反應的平衡常數,用于測量較大物體可逆地分離(解離)成較小成分的傾向。解離常數是結合常數的倒數。 雖然解離常數是動力學理論的參數, 但是它在生物化學,尤其實驗設計上有現實意義的指導作用。
對于一個可逆的蛋白結合過程
(1)P+L⇌P L
PL是蛋白P和配體L的親和産物。解離常數KD定義為
(2)KD=[P]e[L]e/[PL]_e=1/KA
其中[P]e’[L]e和[PL]e分别是到達平衡時,P、L和結合物PL的濃度。KA是結合常數。結合率ϴ定義為蛋白P與配體L結合成PL的比例。
(3)ϴ=[PL]_e/[P]t
[P]t是起始的蛋白P總濃度。平衡時蛋白濃度
(4)[P]e= [P]t-[PL]e
等式(2)變成
(5) KD=([P]t-[PL]_e)[L]e/[PL]
等式(5)變成
(6) [PL]_e/[P]t=[L]e/(KD+[L]e)
結合率ϴ轉化為
(7) ϴ=[PL]_e/[P]t=[L]e/(KD+[L]e)
平衡時省餘未結合配體濃度
(8)[L]e=ϴ KD/(1-ϴ)
當蛋白L有一半結合時,ϴ=0.5
(9) [L]e=KD
更後平衡狀态結合配體的濃度就等于解離常數。下面闡述其實用價值。
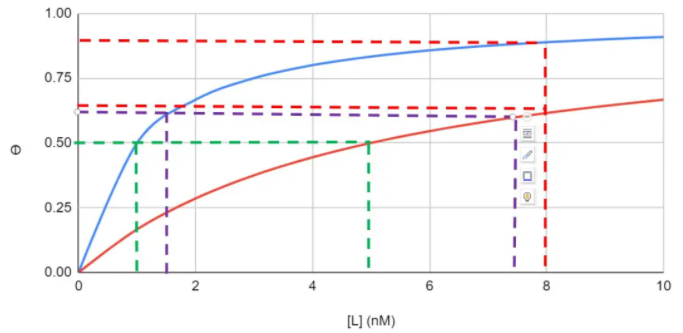 圖2. 不同配基濃度和蛋白結合率ϴ。
圖2. 不同配基濃度和蛋白結合率ϴ。
KD=1nM——;KD=5nM——
例如KD為1nM時,更後剩餘的配基平衡濃度為1nM,一半的蛋白會與配體結合(ϴ=0.5)。KD為5nM時,更後剩餘的配體平衡濃度為5nM時,一半的蛋白會與配體結合(ϴ=0.5)。如果想要提高蛋白結合率到六成(ϴ=0.6圖中紫線),就要增加配基濃度,達到更後配基平衡濃度分别為1.5nM(KD=1nM)和7.5nM(KD=5nM)。對于蛋白A填料來說,配體就是抗體,不同動物/總類的抗體有不同的KD。如果給與足夠時間,結合達到平衡後(靜态載量),沒結合抗體的濃度也不同。KD小,會有更高的靜态載量,分離得更完全。 要想提高低KD抗體的載量,隻能提高填料表面蛋白A的密度。如果時間短,沒有達到更後的結合平衡,現實的例子就是抗體流過蛋白A填料柱。在相同時間裡,KD小的,會有更多的抗體與蛋白A結合。對于同樣的KD流速低,時間長,動态載量也會更高。
反之, 在更後配體平衡濃度為8nM(圖中紅線)時,KD小(1nM)的蛋白結合率能達到0.89,而KD大(5nM)的蛋白結合率隻有0.62。 這對于無蛋白檢測時,試劑濃度選定有幫助。比如ELISA的二抗(檢測抗體)或者熒光标記的二抗以及鍊黴親和素(Streptavidin)濃度确定後,KD對蛋白(被檢測物)的濃度測定的影響就顯而易見。KD小的被檢測蛋白,比如蛋白A或者蛋白A的填料,結合率高,檢測結果更準确。如果KD較大,就要提高二抗濃度,以确保檢測數據可信度,或者縮短實驗周期。
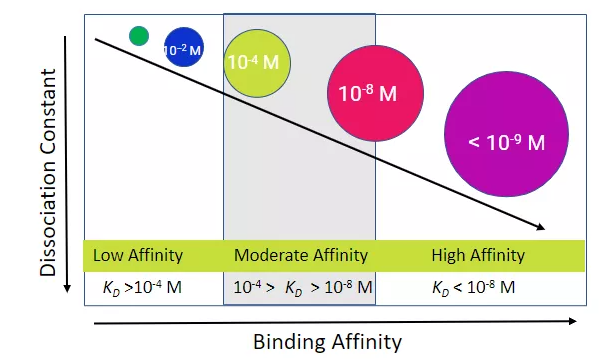
圖3. 蛋白結合強弱劃分定義
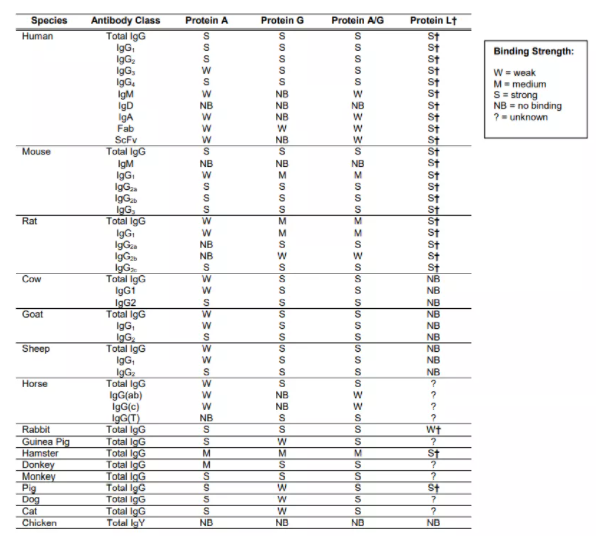
在分子生物學上,KD<10-8M (10nM或者0.01μM)屬于強結合; 10-4M>KD>10-8M屬于中等結合;KD>10-4M (0.1mM)屬于弱結合。蛋白A與不同種類抗體結合的強弱不同。例如protein A與人類IgG1、IgG2和IgG4的KD約為2×10−9M,屬于強結合。下表列出不同抗體與蛋白A結合的強弱情況。蛋白檢測,分離純化過程中,應該參照結合強弱,設計操作方案。
鍊黴親和素(streptavidin)是生物化學常用的試劑。它于生物素(biotin)結合的KD非常小,僅為~10−14M。 強度與共價鍵類似。前文介紹過,鍊黴親和素是非常穩定50KD蛋白,經常用來與熒光、紅外、ELISA标記等化學結合而不失去其生物活性。生物素是分子量244,帶有羧基的小分子。 容易與蛋白化學結合。這樣帶有标記的鍊黴親和素,與帶有生物素的蛋白結合,從而避免直接标記蛋白。鍊黴親和素和生物素KD小。對比于直接标記二抗的方法,采用标記的鍊黴親和素-生物素的方法用量小、時間短,達到準确檢測的目的。基于這種原因,标記的鍊黴親和素、化學活化的生物素以及生物素結合的二抗等蛋白檢測試劑,比較容易購買,這對于實驗方案設計非常便利。
作者✦

王國斌,美籍華人博士,在生命科學和表面化學領域有着20多年的産品研發經驗。擁有反相表面聚合技術等多項發明專利,并有GRAFT-COAT™塗層技術和蛋白質的HydroGel™塗層載玻片等多款專利産品面世。曾就職于多家醫療器材和生物科技公司,包括Perkin Elmer和SRU Biosystems,參與開發了 BIND™生物傳感器。
王國斌博士憑借在高分子化學、表面科學、蛋白質兼容表面等方面的豐富經驗,在加入月旭科技後,主持研制了“續淨一号”銀離子消毒液,并對月旭科技的蛋白純化系列産品的研發提供了ji大的技術支持。為今後月旭科技在生命科學領域的發展注入一劑強心針。





