
提示
分析方法驗證,分析方法确認和分析方法轉移,你能分得清嗎
2020-05-29
任何分析檢測的目的都是為了獲得穩定、可靠和準确的數據,方法驗證在其中起着極為重要的作用。方法驗證的結果可以用于判斷分析結果的質量、可靠性和一緻性,這是所有質量管理體系不可分割的一部分。
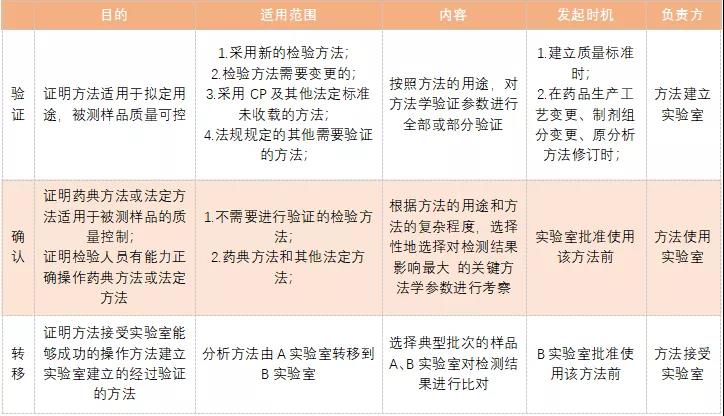
無論什麼方法,在使用之初,一般要求對分析方法進行驗證、确認(或稱證實)或重新驗證,如果是兩個實驗室之間還涉及到分析方法轉移。那麼,方法驗證、确認和轉移究竟有什麼區别及聯系呢?相信很多小夥伴都是不了解的,即使了解也不能準确的給出具體的答案。不知道的小夥伴有福了,今天咱們就來具體的說說。
(1)法規要求:新版GMP
第二百二十三條 物料和不同生産階段産品的檢驗應當至少符合以下要求:
(一)企業應當确保藥品按照注冊批準的方法進行全項檢驗:
(二)符合下列情形之一的,應當對檢驗方法進行驗證:
1. 采用新的檢驗方法;
2. 檢驗方法需要變更;
3. 采用《中華人民共和國藥典》及其他法定标準未收載的檢驗方法;
4. 法規規定的其他需要驗證的檢驗方法;
(三)對不需要進行驗證的檢驗方法,企業應當對檢驗方法進行确認,以确保檢驗數據準确、可靠。
(1)法規要求:中國藥典(2020年版)凡例
檢驗方法和限度;
本版藥典正文收載的所有品種,均應按規定的方法進行檢驗。如采用其他方法,應将該方法與規定的方法做比較試驗,根據試驗結果掌握使用,但在仲裁時仍以本版藥典規定的方法為準。
(1)法規要求:分析方法确定、轉移、驗證相關指南
機構或組織 | 文件名稱 |
美國藥典(USP) | |
人用藥品注冊技術 要求國際協調會(ICH) | Q2(R1)Validation of Analyt8ical Procedures Q2(R1)分析方法驗證 |
《中國藥典》2020年版 | 通則9099分析方法确認指導原則 通則9100分析方法轉移指導原則 通則9101分析方法驗證指導原則 |
(2)驗證的定義
USP(1225)
ICH Q2(R1):分析方法驗證的目标是闡明分析方法适用于它所期望的應用目的;
FDA工業指南:方法驗證是一個闡述分析方法适合于其使用目的的過程;
SFDA(驗證):證明任何操作規程(或方法),生産工藝或系統能夠達到預期結果的一系列活動;
ChP(9109):證明采用的方法适合于相應檢測要求。
(2)确認的定義
定義:指評估檢驗時所依據的藥典标準和其他法定标準在各實驗室實際使用情況下是否能達到其檢驗要求的過程。
USP(1225)/(1226):出現在USP中的方法被認為已驗證,如果作為已批準的ANDA(簡略新藥申請)的一部分,它們也被認為是驗證過的。确認不是重複驗證過程,不需要驗證其準确性和可靠性,但需要确認其在實際使用條件下的适應性。确認包括所設計方法的性能參數,如那些在通則中描述的性能參數。
ChP:是指首次使用法定分析方法時,由現有的分析人員對分析方法中關鍵的驗證指标進行有選擇性的考察,以證明方法對所分析樣品的适用性,同時證明分析人員有能力使用該法定分析方法,分析方法的确認并不是重複驗證過程,本指導原則不涉及微生物分析方法的确認。
(2)轉移的定義
USP(1224):是将非法定方法從一個實驗室轉移至另一個實驗室,即為分析方法轉移。是一個按照已建立的實驗室研究來證明方法的性能參數符合期望的分析應用的過程。
國内ChP:是一個文件記錄和試驗确認的過程,目的是證明一個實驗室(方法接受實驗室)在采用另一個實驗室(方法建立實驗室)建立并經過驗證的非法定分析方法檢測樣品時,該實驗室有能力成功操作該方法,檢測結果與方法建立實驗室檢測結果一緻。分析方法轉移是保證不同實驗室之間獲得一緻,可靠和準确檢測結果的一個重要環節,同時也是對實驗室檢測能力的一個重要評估。
應用:通常不适用于法定方法,但可以參考。
參數(parameter) | 機構(organization) |
專屬性/特異性(specificity) | USP,EP,ChP,ICH |
選擇性(selectivity) | ISO 17025 |
精密度(precision) | USP,EP,ChP,ICH |
重複性(repeatability) | ChP,ICH,ISO 17025 |
中間精密度 (intermediate precision) | ChP,ICH |
重現性(reproducibility) | ChP,ICH,USP和ISO 17025 |
準确度(accuracy) | USP,EP,ChP,ICH,ISO 17025 |
線性(linearity) | USP,EP,ChP,ICH,ISO 17025 |
範圍(range) | USP,ChP,ICH |
檢測限(detection limit) | USP,EP,ChP,ICH,ISO 17025 |
定量限(quantitation limit) | USP,EP,ChP,ICH,ISO 17025 |
耐用性(robustness) | USP,EP,ISO 17025 |
粗放性(ruggedness) | USP,ChP,ICH |
表1.不同國際組織和藥典要求的方法學驗證參數
同時,由于方法的檢測目的不同,各方指導原則對于不同檢測目的的方法所要求的驗證的參數也有所不同,表2中列出了ICH指導原則中規定的不同檢驗目的需要驗證的參數。
參數 | 含量測定 | |||
定量法 | 限度 | |||
準确度 (accuracy) | - | + | - | + |
精密度 (precision) | ||||
重複性 (repeatability) | - | + | - | + |
中間精密度 (intermediate precision) | - | + | - | + |
重現性 (reproducibility) | - | + | - | + |
專屬性 (specificity) | + | + | + | + |
檢測限 (detection limit) | - | - | + | - |
定量限 (quantitation limit) | - | + | - | - |
線性 (linearity) | - | + | - | + |
範圍 (range) | - | + | - | + |
表2.ICH 指導原則中規定的不同檢驗目的需要驗證的參數
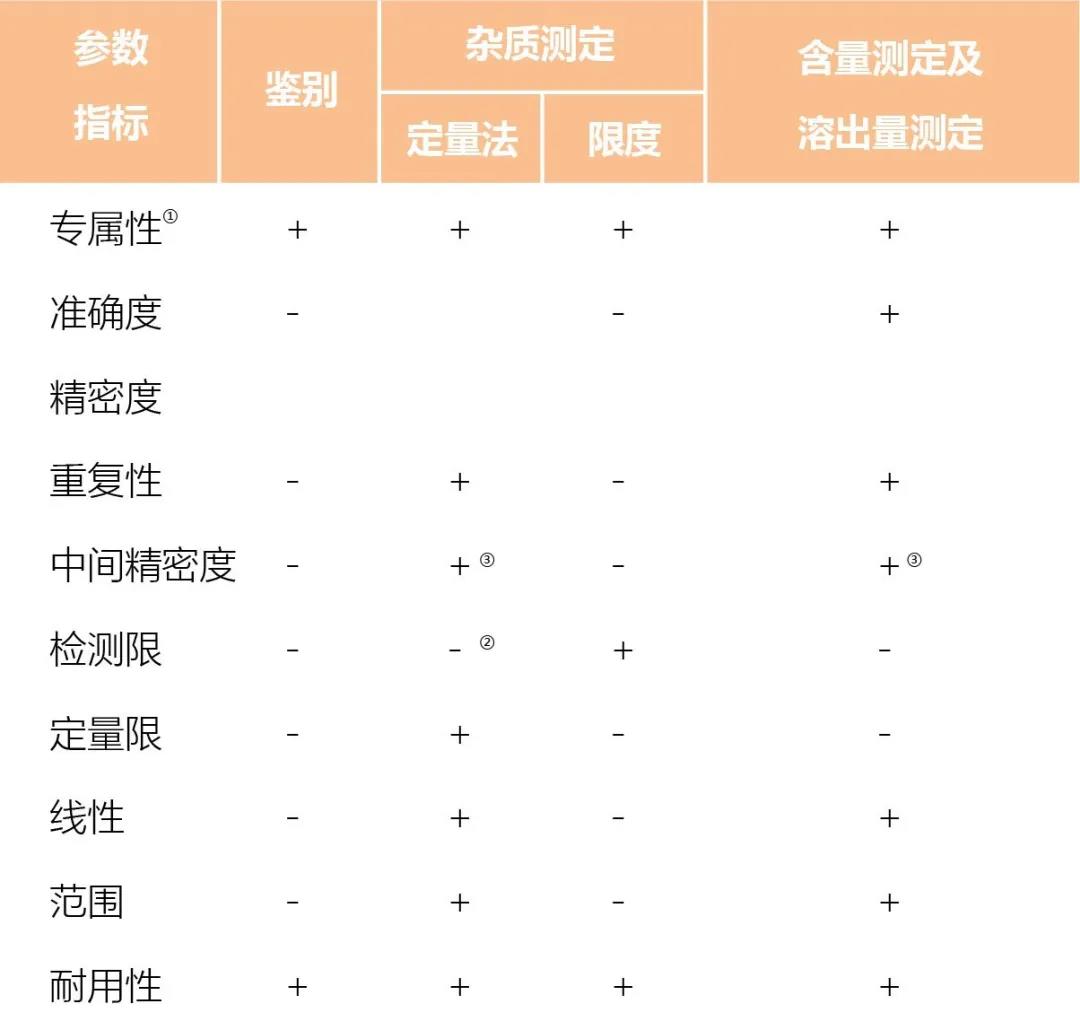
表3.2020版中國藥典方法驗證的參數
① 如一種方法不夠專屬,可用其他分析方法予以補充。
② 視具體情況予以驗證。
③ 已有重現性驗證,不需驗證中間精密度。
藥品分析方法驗證、 轉移和确認的目的是證明所采用的分析方法适合于相應檢測要求和目的,被測樣品質量可控,保證得到一緻的、可靠的和準确的測定結果,同時也證明檢驗人員有能力成功地操作分析方法。一個好的分析方法,對于獲得準确可靠的檢驗結果至關重要。





